Por Sonia
Viviana Beltrán Catama. Maestria en Docencia de la Química. 2022.
Desde tiempos remotos, el estudio del efecto del calor sobre la materia ha representado tema de discusión en el avance de la ciencia, este ha conllevado al estudio de la combustión a partir de la experimentación. Desde los planteamientos de Aristóteles, el fuego ha sido unos de los cuatro principios de la materia, junto con la tierra, el agua y el aire. Desde este planteamiento es que Ernst Stahl propuso la teoría del flogisto, a continuación, se comentan algunos apartados del documento “reflexiones sobre el flogisto”, de Antoine Laurent Lavoisier con el fin de aludir a la construcción historia que permite en la actualidad hablar del oxígeno
Stahl proponía que el flogisto era el principio que contenía todos los cuerpos, y el cual les confería un principio inflamable, este les daba la capacidad de quemarse (combustión). En dicho proceso se afirmaba se perdía el flogisto y que una vez consumido este principio, ya no habría más lugar al fenómeno. Sin embargo, este fenómeno empezó a presentar muchas dificultades, una de ellas, fue el no poder explicar la ganancia de peso luego de que se llevara a cabo una reacción de combustión de los metales, de ahí que, es válido preguntar; ¿cómo se explicaba el aumento de peso de la cal obtenida luego de un proceso de combustión? Indudablemente, los primeros aportes de Stahl permitieron plantear dos importantes descubrimientos, el primero, que los metales son cuerpos combustibles y que por ende se debe considerar toda calcinación como un proceso de combustión y por otro lado que la propiedad de quemarse o de ser inflamable, se puede transmitir de un cuerpo a otro.
El inicio de una serie de cuestionamientos y experimentos, empezaban a surgir, por ello fue importante caracterizar el flogisto, el cual se destacaba por ser considerado como principio inflamable, no tener peso, ser materia sutil, ser materia pura de la luz y ser considerado el principio de los colores. Ante las dificultades del modelo del señor Stahl, Baumé reconoce que se debe hacer una modificación a dichos planteamientos, en un comienzo, acepta la razón de que el flogisto es considerado un principio inflamable, sin embargo, se lleva una disyunción al plantear que el fuego libre y el elemento terroso que entra en la composición del flogisto, pueden combinarse en infinidad de proporciones. (Lavoisier, 1783, pág. 42)
En el
análisis de la combustión del mercurio – hierro, se evidenció un comportamiento
diferente a lo visto en la combustión del azufre y del fosforo, allí, por el
contrario, se identificó un aumento de peso, el cual no pudo ser comprobado.
Los planteamientos de Stahl, llevaban a relacionar la combustión desde el
análisis de los cuerpos orgánicos con la calcinación de los metales, a
continuación se esquematizan los dos procesos:
Metal (calentado al aire) → cal metálica (actualmente óxido
metálico) + flogisto
Azufre (calentado al aire) → ácido vitriólico
(actualmente ácido sulfúrico o anhidro) + flogisto
Esta teoría planteaba que la combustión de los metales estaba asociada a la combinación de las diferentes tierras al flogisto, explicando porque los cuerpos se quemaban y relacionando la combustión y la calcinación en un mismo fenómeno. La transferencia de este flogisto en dicho proceso, permitió hablar de la reducción, ¿es posible pensar, que desde estos estudios, se asocia la oxidación y reducción a un fenómeno de transferencia?. De acuerdo con estudios realizados por Stahl, los cuerpos combustibles se inflamaban porque contenían un principio inflamable, de ahí que, Baumé, menciona dos tipos de cuerpos, los que presentan mayor principio inflamable, como el azufre, el carbono y el fósforo y los otros que además de tener el principio inflamable, tiene un principio terroso. De estos estudios, Stahl esperaba que se perdiera peso dado que se perdía flogisto.
Lavoisier, reconoció los planteamientos de Stahl, los cuales por un lado relacionan la combustión con la calcinación y permite pesar que la cualidad de inflamabilidad puede ser transferida de un cuerpo a otro, en donde por ejemplo la acción del carbono sobre el acido vitriólico, permite obtener el azufre, perdiendo el carbono la capacidad de quemarse y transfiriéndosela al azufre.
S (quemado al aire) → ácido
vitriólico + flogisto
C (quemado al aire) → ácido carbónico + flogisto
Con el fin de analizar el aire de mercurio, Priestley mezclo una onza (unos 30 gramos) de esta cal con 48 granos (unos 2,5 gramos) de carbón en polvo, introdujo todo en una pequeña retorta de vidrio de unas dos pulgadas cúbicas (unos 40 mililitros) de capacidad, que puso en un horno de reverbero proporcionado a su tamaño. El cuello de la retorta tenía más o menos un pie (32 milímetros) de diámetro; había sido acodado en diferentes sitios con una lámpara de esmaltador, y su extremidad estaba dispuesta de modo que podía ponerse debajo de una campana de vidrio bastante grande, que estaba llena de agua e invertida en una herrada también llena de agua. (Figura 1)
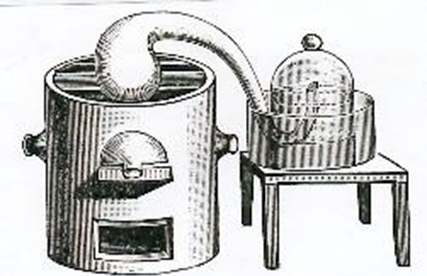
Figura 1. Experimento análisis
de aire de mercurio
Posterior a estos planteamientos, Lavoisier realizó algunos experimentos de calcinación de los metales mediante lentes, con cantidades determinadas de aire, observó que a medida que el metal se calcinaba el volumen de aire disminuía y el peso del metal aumentaba en la misma proporción que el aire disminuía, razón por la cual se demostró que el aumento del peso era una de las condiciones de la calcinación metálica, es decir, que el azufre, el fósforo, y todo los cuerpos combustibles, aumentaban de peso al quemarse y que esto se debía a la combinación y fijación del aire.
En consonancia con lo descrito anteriormente, en este escrito resulta importante mencionar los trabajos realizados por Joseph Priestley, quien se interesó por conocer la composición del aire y que sin lugar a duda sus experimentos, aportarían a la consolidación de lo que en la actualidad se conoce como oxígeno. En 1774, Priestley, realiza un experimento para comprobar los efectos de extraer aire del mercurio calcinado.
Dado el interés del señor Priestley por el estudio de los aires, dentro de sus aportes, se resalta el estudio de gases solubles en agua, que en la actualidad se les conoce como amoniaco (aire alcalino), dióxido nitroso (aire nitroso desflogistizado) y cloruro de hidrogeno (aire ácido marino). Con el fin de continuar complementado los estudios respecto al aire, realizo otro experimento, hizo una mezcla de aire nitroso: aire de mercurio + aire nitroso: este experimento tuvo como producto la formación de monóxido de nitrógeno, su posterior análisis se realizado a partir de la experimentación con una vela; al someter una vela en una campana con esta mezcla de gases, se dio cuenta que la vela mantenía mucho más intensa y vigorosa la llama. Posteriormente, colocó una planta dentro del aire enrarecido, y observó que de algún modo el aire parecía regenerarse, generando que la vela volviera a arder nuevamente (este descubrimiento dio paso a lo que en la actualidad se conoce como el proceso de fotosíntesis) (Figura 2)
Figura 2. Análisis
del aire: ratones y planta
Con estos experimentos, se logró comprobar que el aire estaba constituido por la mezcla de dos gases y que luego de realizarse la calcinación del mercurio, éste absorbía la parte respirable del aire, siendo el residuo un aire no apto para la respiración humanan
Consecuente a esto; Lavoisier propuso cuatro fenómenos asociados con la combustión: no hay combustión real con desprendimiento de luz y llama, en las combustiones hay absorción del aire en la cual se lleva el proceso, toda combustión implica un aumento de peso del cuerpo quemado y en toda combustión, hay desprendimiento de luz y calor. Los fenómenos mencionados, se pudieron validar gracias a que Lavoisier decidió implementar el cálculo de pesos en su experimento, lo cual abre la puerta al debate de la teoría del flogisto y reflexionar en torno a la conservación de los pesos.
Finalmente, el hecho de que Lavoisier repitiera el experimento de Priestley de manera sistemática permitió descubrir que luego de la combustión del óxido de mercurio con carbono, una parte del gas formado era soluble en gua, al cual llamo; “aire fijo” (actualmente, dióxido de carbono) y que la otra parte, la cual era insoluble en agua, era el que favorecía la combustión. Este ultimo no precipitaba el agua de cal y no era absorbido por los álcalis, razón por la cual logran concluir que el oxido de mercurio es una cal metaliza, el gas que no era fijo lograba mantener mejor la combustión que el aire atmosférico y que era ese gas el responsable del aumento de peso del metal durante la combustión.
“Por lo
demás, lo repito, al atacar aquí la doctrina de Stahl no me propongo
sustituirla por una teoría rigurosamente demostrada, sino solamente por una
hipótesis que considero más probable, más conforme a las leyes de la
naturaleza, y que me parece encerrar explicaciones menos forzadas y
contradictorias. Las circunstancias no me han permitido exponer aquí más que el
conjunto del sistema y un resumen de sus consecuencias; pero me propongo
retomar sucesivamente cada parte, y desarrollarla en diferentes memorias. Me
atrevo a asegurar de antemano que la hipótesis que propongo explica de una
manera muy feliz y simple los principales fenómenos de la física y de la
química.” (Lavoisier,
1783, pág. 478-78)
Referencias
bibliográficas
· Lavoisier, A. L. (1783). Reflexiones sobre el
flogisto. En "Memorias sobre el oxígeno, el calórico y la
respiración", EMECE Editores S. A., Buenos Aires,
Priestley, J. (1776). Sect. III - Of Dephlogisticated Air, and of the
constitution of the Atmosphere. En “Experiments and Observations on Different
Kinds of Air” London.
Kats, M. (2011). La teoría del flogisto y la
revolución química. Epistemología e historia de la química. Tomado de http://www.rlabato.com/isp/qui/historia-006-2011-flogisto_rev_qui.pdf.

